TIPOS DE REACCIONES QUÍMICAS:
Los dos tipos de ruptura de enlace (Homolítico y heterolítico) permiten clasificar las reacciones orgánicas en dos grandes grupos: REACCIONES POLARES y REACCIONES NO POLARES.
REACCIONES NO POLARES:
Se caracterizan por la formación de radicales libres como productos intermedios, los intermedios son especies químicas que se producen en una etapa de la reacción y se consumen en las subsiguientes. Los radicales libres son especies químicas minerales u orgánicas, que poseen un electrón desaparedado y se forman cuando ocurre rompimiento homolítico de un enlace, por medio de la luz o el calor. La energía calórica o lumínica debe ser igual o mayor que la energía de enlace.
Los radicales libres son especies muy reactivas, por lo cual una vez formados buscar aparear su electrón, para estabilizarse, chocando con otro radical libre o contra una molécula neutra, en este último caso se origina otro radical libre.
Para radicales libres de tipo alifático y alicíclico, la facilidad de obtención y por consiguiente la estabilidad, es así:
3rio>2rio>1rio> CH3•
CLASIFICACIÓN DE LAS REACCIONES NO POLARES:
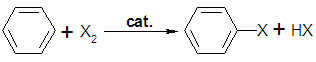
Las reacciones no polares pueden ser de sustitución o de adición.
La sustitución conlleva a reemplazar átomos del sustrato por átomos del reactivo. En la reacción de adición, el reactivo se une al sustrato a través del rompimiento de enlaces múltiples