ISÓMERIA ÓPTICA
PROYECCIONES DE FISCHER
Proyectar consiste en dibujar en dos dimensiones (plano) una molécula. En la proyección de Fischer la molécula se dibuja en forma de cruz con los sustituyentes con los sustituyentes que van al fondo del plano en la vertical y los grupos que salen hacia nosotros en la horizontal, el punto intersección de ambas líneas representa el carbono proyectado.
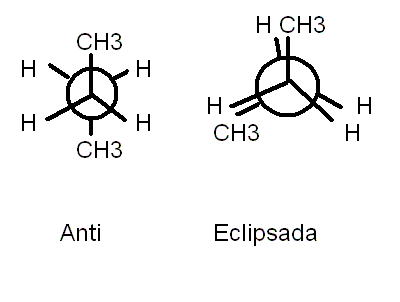
La proyección de Fischer puede hacerse para varios carbonos de la molécula. El primer paso consiste en dibujar la molécula eclipsada y en segundo lugar girarla dejando unos grupos hacia nosotros y otros al fondo del papel.